삼성바이오로직스는 창립 13년 만에 제품 허가 기준 글로벌 규제기관 제조 승인 건수 300건을 돌파했다고 10일 밝혔다.
규제기관 제조 승인은 바이오의약품의 제조 및 관리 전 과정에 대해 제조·품질관리기준(GMP)과 품질 적합성이 검증 됐음을 뜻한다. 위탁생산(CMO) 기업이 생산한 의약품을 시장에 출시하기 위해서는 해당 국가 규제기관의 승인이 필요하다.
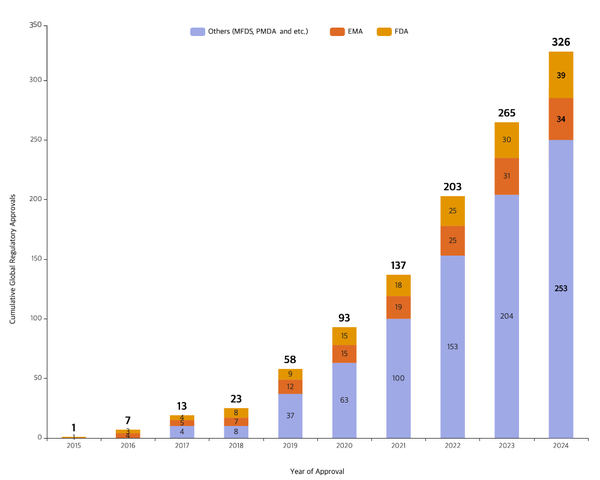
삼성바이오로직스는 지난달 기준 미국 식품의약국(FDA) 39건, 유럽 의약품청(EMA) 34건 등 총 326건의 제조 품목 규제기관 제조 승인을 획득했다. 생산능력 확장과 수주 증가에 따라 해마다 승인 건수를 늘려가고 있다. 규제기관 실사 통과율은 업계 최고 수준을 유지하고 있다.
삼성바이오로직스가 까다로운 규제기관의 실사에도 성공적인 실적을 쌓은 배경에는 전문 인력 양성, 전자 데이터 관리 시스템, 비대면 실사 역량 구축 등이 꼽힌다.
먼저 삼성바이오로직스는 2011년 설립직후부터 실사전문팀을 구성해 전문 인력을 양성했다. 실사전문팀은 규제기관과 고객사 실사를 전담하는 팀이다. 실사에 필요한 새로운 가이드라인을 분석하고 실사 대응 인력을 교육했다. 이에 2015년 70여명이던 글로벌 제조 승인 대응 가능 인력을 현재 기준 약 550명까지 늘렸다.
또한 전자문서와 전자품질 관리 시스템을 도입해 생산 전반에서 발생하는 많은 데이터를 의약품 제조 및 품질관리 기준에 맞춰 디지털화하고 실시간 보관 및 열람할 수 있게 했다. 이를 통해 규제기관의 데이터 검증에도 빠른 대응이 가능하다.
마지막으로 라이브 버추얼 시스템(Live-Virtual System)을 구축해 비대면 실사 역량을 강화했다. 모든 공정 과정을 빈틈없이 볼 수 있게 각 기기마다 여러 앵글의 카메라를 장착, 현장에 온 듯한 공장 투어를 구현했다. 실사 현장에는 정보기술(IT) 지원 팀을 상시 대기시켜 기술적 문제에 즉각 대응할 수 있다. 이를 통해 코로나19 때에도 기관과 고객사의 비대면 실사를 184건 이상 진행했다.
존 림 삼성바이오로직스 사장은 “앞으로도 품질경영을 기반한 끊임없는 기술 혁신으로 고품질의 바이오의약품을 시장에 적기 공급할 수 있게 노력하겠다”고 말했다.














