[이코노믹리뷰=최지웅 기자] 식품의약품안전처가 영국 아스트라제네카의 코로나19 백신을 국내에 빠르게 도입하기 위해 사전 절차에 착수했다.
27일 식약처는 아스트라제네카에서 개발 중인 코로나19 백신에 대해 허가전담심사팀을 구성하고 전임상 시험자료에 대한 사전검토를 시작했다고 밝혔다.
식약처는 현재 코로나19 의약품의 신속한 허가를 위해 허가신청이 예상되는 제품에 대해 신청 예정일로부터 90일 전에 '허가전담심사팀'을 구성하고 사전심사를 할 수 있는 체계를 갖추고 있다.
아울러 코로나19 백신의 신속한 임상시험 진입을 위해 지난 6월에 제정한 '코로나19 백신 개발 시 고려사항'을 개정했다. 주요 개정사항은 3상 임상시험을 위한 자료요건 및 설계방법, 시판 후 고려사항, 미국 식품의약국(FDA) 등 해외 코로나19 백신 지침 추가 등이다.
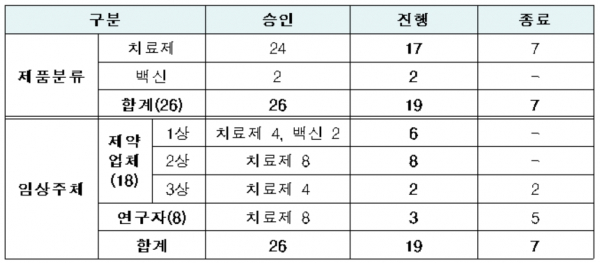
식품의약품안전처에 따르면 지금까지 국내에서 승인된 코로나19 의약품 임상시험은 치료제 24건, 백신 2건 등 총 26건이다.
이중 7건의 치료제 임상이 종료돼 현재 진행 중인 임상은 치료제 17건, 백신 2건으로 총 19건이다.
제약업체 임상은 16건, 연구자 임상은 3건이다. 제약업체 임상시험은 2상이 8건으로 가장 많고, 1상 6건, 3상 2건이다.
치료제로는 부광약품·신풍제약·대웅제약 등의 항바이러스제를 비롯해 셀트리온 중화항체 치료제, 녹십자 혈장 치료제, 엔지켐생명과학 면역조절제 등이 개발 중이다. 백신은 제넥신이 환자를 모집해 DNA 백신의 임상시험을 진행하고 있다.
최지웅 기자
jway0910@econovill.com


