
에스티팜(237690)이 올리고 위탁개발생산(CDMO) 안정화에 이어 에이즈 치료제, 항암제 등 신약 개발로 사업 영역을 적극 확장하고 있다.
25일 제약바이오 업계에 따르면 에스티팜은 올 하반기에도 올리고 원료 기반 성장세가 지속될 전망다. 최근 에스티팜은 미국 식품의약국(FDA)으로부터 렉비오 상업화 원료 공급을 위한 제조소 실사(PAI)에서 무결점 등급을 획득했다. PAI는 신약 승인을 받기 위한 절차다.
지금까지는 미국 시장에 임상용 올리고핵산치료제 원료의약품 수출만 가능했지만, 이번에 획득한 cGMP(우수의약품품질관리기준) 승인을 통해 미국 시장에 대규모 상업화 원료 수출까지 가능하게 됐다.
내년 상반기까지 2개의 올리고핵산 치료제를 포함한 총 4개 의약품에 대한 FDA PAI 실사가 예정돼 있다. 에스티팜이 원료를 공급하는 신약들의 FDA 승인이 임박했음을 의미한다.
에스티팜은 올해 제1올리고핵산치료제 원료공장 증설을 완료했다. 총 1500억원을 투자한 제2올리고핵산치료제 원료공장도 오는 2025년 완공을 목표로 추진 중이다. 증설까지 더해지면 전체 생산 능력과 수주 규모도 크게 증가할 것으로 전망된다.
임윤진 대신증권 애널리스트는 “최초의 실사에서 무결점 등급을 획득한 만큼 후속 실사도 긍정적 결과가 기대된다”며 “후기 임상 리보핵산(RNA) 치료제 후보물질의 허가 시기가 가까워지며 에스티팜의 상업화 물량 수주 가능성이 늘고 있다. 내년부터 올리고핵산 상업화 원료의 비중이 본격 확대될 것”이라고 분석했다.
에스티팜 관계자는 “앞으로도 올리고 CDMO 관련 매출을 확대하는 것을 목표한다”며 “계획된 생산설비 증설을 완료해 2030년까지 올리고 CDMO 매출 1조원 달성을 목표하고 있다”고 말했다.
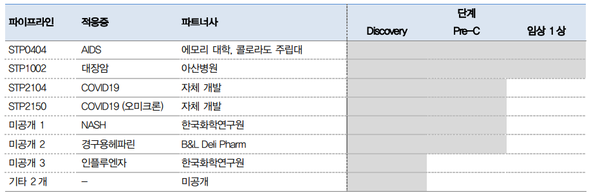
에스티팜은 매년 매출의 10% 이상을 신약개발에 공격적으로 투자하고 있다. 신약 파이프라인 임상 연구가 확대되며 상반기 별도 매출액 대비 18%를 연구개발비에 투자했다.
에스티팜은 RNA 신약 개발 분야에서 글로벌 시장의 주목을 받고 있다. RNA 신약 개발을 위해 지난해 4월과 8월 미국 mRNA 및 유전자치료제(CAR-NKT) 플랫폼 기반 신약개발 바이오텍 레바티오 및 mRNA 신약 파이프라인을 개발하는 버나젠을 설립했다. mRNA 기반 코로나19 백신도 개발 중이다. 지난 3월 식약처로부터 ‘STP2104’ 임상 1상 IND를 승인받았다. 연내 임상 1상 결과 발표가 예상된다.
개발 단계가 가장 앞서 있는 파이프라인으로는 후천성면역결핍증(에이즈) 치료제 'STP0404'가 있다. 이달 STP0404는 임상 1상 시험에서 안전성을 입증했다. 연내 미국 FDA에 IND를 제출 및 임상 2a상 진입을 목표한다.
경구용 대장암 치료제 ‘STP1002’도 미국에서 임상 1상 막바지 단계에 접어들었다. 지난 2019년 11월 미국 FDA로부터 임상 1상 IND 승인을 받았다. 현재 미국에서 임상 1상을 진행 중이다. 상업화에 성공하면 첫 경구용 대장암 치료제가 된다.
에스티팜 관계자는 “임상 1상은 진행성 고형암을 동반한 성인 환자 30명을 대상으로 STP1002의 최대 내약용량과 안전성, 내약성, 약동학 등 특성을 확인하는 방식으로 진행된다”며 “연내 임상 1상이 완료될 것으로 예상한다”고 말했다.


